Флуоресцентен резонансен трансфер на енергия (FRET)
Флуоресцентен резонансен енергиен трансфер (FRET) е процес на нерадиационен енергиен трансфер, при който енергията на възбуденото състояние на донора се прехвърля към възбуденото състояние на акцептора чрез взаимодействие на междумолекулни електрически двойки.Този процес не включва фотони и следователно не е радиационен.Този анализ има предимствата да бъде бърз, чувствителен и прост.
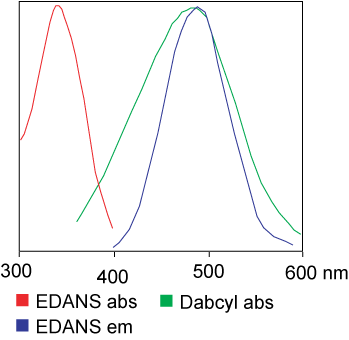
Багрилото, използвано в FRET анализа, може да бъде идентично.Но в повечето приложения всъщност се използват различни багрила.Накратко, прехвърлянето на светлинна резонансна енергия е прехвърлянето на двойка диполи от донора (багрило 1) към акцептора (багрило 2), когато донорната група е възбудена.Като цяло, емисионният спектър на донорната флуорофорна група се припокрива с абсорбционния спектър на акцепторната група.„Когато разстоянието между двата флуорофора е подходящо (10 — 100 A), може да се наблюдава прехвърлянето на флуорофорна енергия от донора към акцептора.“Методът на пренос на енергия зависи от химическата структура на рецептора:
1. Преобразува се в молекулярна вибрация, т.е. светещата светлина на преноса на енергия изчезва.(Рецепторът е гасител на светлина)
2. Излъчването е по-интензивно от самия рецептор, което води до червено изместване във вторичния флуоресцентен спектър.(Рецепторите са излъчватели на светлина).
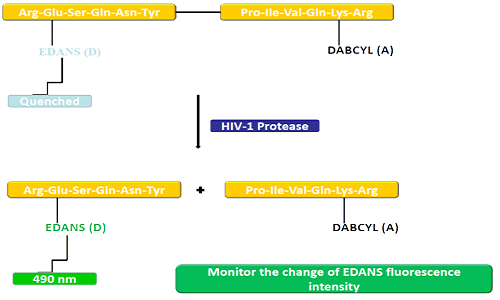
Донорната група (EDANS) и акцепторният ген (DABCYL) са равномерно свързани с естествения субстрат на ХИВ протеазата и когато субстратът не е изключен, DABCYL може да потисне EDANS и след това да стане неоткриваем за флуор.При прекъсване на HIV-1 протеазата EDANS вече не се потушава от DABCYL и впоследствие могат да бъдат открити EDANS луциферазите.Наличието на протеазни инхибитори може да се наблюдава чрез промени в интензитета на флуоресценция на EDANS.
FRET пептидите са удобни инструменти за изследване на неспецифичността на пептидазата.Тъй като неговият реакционен процес може да бъде непрекъснато наблюдаван, той осигурява удобен метод за откриване на ензимната активност.Блясъкът, произведен след хидролизата на пептидните връзки от донора/акцептора, осигурява мярка за ензимната активност при наномоларни концентрации.Когато пептидът FRET е непокътнат, той показва внезапно изчезване на вътрешната светкавица, но когато която и да е пептидна връзка срещу донора/акцептора се скъса, тя освобождава светкавица, която може да бъде открита непрекъснато и след това ензимната активност може да бъде количествено определена.
Време на публикуване: 14 август 2023 г