Модификацията на фосфорилиране играе решаваща роля в живота на клетките и засяга множество аспекти. Фосфорилирането на протеини е тясно свързано с различни биологични процеси, като възстановяване на увреждане на ДНК, регулиране на транскрипцията, трансдукция на сигнала и регулиране на клетъчната апоптоза. Изучаването на фосфорилирани протеини и пептиди помага да се разкрият механизмите на тези процеси и да се задълбочи нашето разбиране за същността на житейските дейности. Биотехнологията на Хонг пептид притежава зряла технология за етикетиране на пептид на фосфорилиране. Използвайки собствените си технологични и суровини предимства, можем да синтезираме пептиди, съдържащи фосфорилиран серин (PSER), фосфорилиран треонин (PTHR) и фосфорилиран тирозин (PTYR) и осигуряват висококачествени пептиди с едно до пет фосфорилиращи места.
Преглед на технологията за маркиране на фосфорилиране:
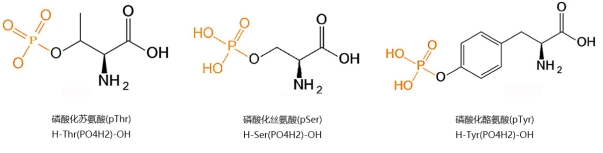
Фосфорилираните пептиди се отнасят главно към хидроксилните групи от серин (SER), тирозин (Tyr) и остатъци от треонин (THR) в пептидната верига, модифицирани в кисели фосфатни естери. Фосфорилираните пептиди играят решаваща роля в изследването на протеиновото фосфорилиране. Ето защо е особено важно дълбоко да се изследват реакциите на фосфорилиране на протеини и пептиди и да се намерят зрели и прости синтетични методи.
Понастоящем методите за модификация на фосфорилирането на пептидите попадат главно в две категории:
(1) Включете директно подходящо защитените фосфорилирани аминокиселини в пептидната последователност:
Първо, аминокиселините, които трябва да бъдат фосфорилирани (като THR, SER или TYR), се подлагат на лечение с фосфорилиране и са защитени по подходящ начин. След това, следвайки процеса на конвенционалния синтез на пептид на твърда фаза (SPPS), фосфорилираните мономери са свързани със специфичните места на полипептида. Този метод е лесен за работа и се превърна в една от основните техники за модификация на пептидите на точковите фосфорилиране.
(2) След синтезиране на полипептидната последователност върху смолата, хидроксилните групи на страничната верига на SER, TYR или THR са фосфорилирани:
При извършване на модификация на фосфорилиране, ако методът за директно кондензиране на фосфорилираните мономери в полипептида е приет, фосфорилираната аминокиселина, поради по -голямата му странична верига, причинява увеличаване на стеричната пречка, което затруднява кондензацията с пептидната верига. Освен това въвеждането на последващи аминокиселини също ще стане сравнително сложно, особено когато има множество фосфорилиращи места. Процесът на синтез ще бъде изключително труден и крайният продукт ще бъде много сложен, което затруднява раздялата и добивът е изключително нисък. Следователно, когато има множество места, изискващи фосфорилиране в полипептидната верига, може да се счита, че първо завършва синтеза на полипептидната последователност на смолата и след това фосфорилиране на хидроксилните групи на страничната верига на Ser, Tyr или Thr. По време на този процес първо селективно отстранете страничната верига за защита на групите на аминокиселината, която ще бъде белязана. За Tyr и THR незащитените аминокиселини на техните странични вериги могат да бъдат директно реагирани. Групите за защита на страничната верига могат да бъдат отстранени количествено при условие на 1% TFA/DCM. При този метод активният междинно съединение на бис-бензил фосфорамидат и тетразол може да бъде генериран чрез реакцията с последния и той може да бъде свързан с хидроксилната група. След това може да се извърши реакция на окисляване при условия на пероксидна киселина за генериране на фосфонил групата, завършваща фосфорилирането.
Време за публикация: 2025-07-16
