Пептидите са клас съединения, образувани от свързването на множество аминокиселини чрез пептидни връзки. Те са повсеместни в живите организми. Досега в живите организми са открити десетки хиляди пептиди. Пептидите играят важна роля за регулирането на функционалните дейности на различни системи, органи, тъкани и клетки и в житейски дейности и често се използват при функционален анализ, изследване на антитела, разработване на лекарства и други области. С развитието на биотехнологиите и технологията за синтез на пептиди, в клиниката са разработени все повече и повече пептидни лекарства.
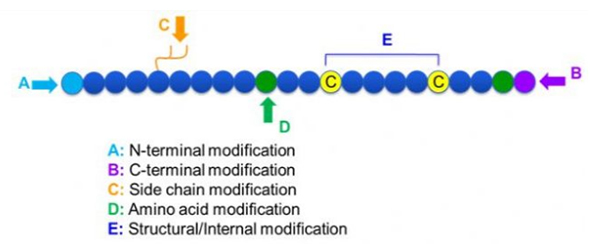
Съществуват голямо разнообразие от пептидни модификации, които могат просто да бъдат разделени на след модификация и модификация на процесите (с помощта на производна модификация на аминокиселини) и N-терминална модификация, С-терминална модификация, модификация на страничната верига, модификация на аминокиселини, модификация на скелета и т.н., в зависимост от мястото на модификация (Фигура 1). Тъй като важно средство за промяна на основната структура на веригата или групите от странична верига на пептидни вериги, пептидната модификация може ефективно да промени физическите и химичните свойства на пептидните съединения, да увеличи разтворимостта на водата, да удължи времето за действие in vivo, да промените тяхното биологично разпределение, да елиминират имуногенността, намаляват токсичните странични ефекти и др. В тази книга се въвеждат няколко основни стратегии за модификация на пептидите и техните характеристики се въвеждат.
1. Циклизация
Цикличните пептиди имат много приложения в биомедицин, а много естествени пептиди с биологична активност са циклични пептиди. Тъй като цикличните пептиди са склонни да бъдат по -твърди от линейните пептиди, те са изключително устойчиви на храносмилателната система, могат да оцелеят в храносмилателния тракт и да проявяват по -силен афинитет към целевите рецептори. Циклизацията е най -директният начин за синтезиране на циклични пептиди, особено за пептиди с голям структурен скелет. Според режима на циклизация, той може да бъде разделен на тип верига от странична верига, Тип на терминалната верига, Тип терминал - Тип терминал (Тип от край до край).
(1) странично-странични
Най-често срещаният тип циклизация на странична верига до странична верига е дисулфидното преодоляване между цистеиновите остатъци. Тази циклизация се въвежда от двойка цистеинови остатъци, които се депректират и след това се окисляват, за да образуват дисулфидни връзки. Полицикличният синтез може да бъде постигнат чрез селективно отстраняване на групи за защита от сулфхидрил. Циклизацията може да се извърши или в разтворител след дисоциация, или в преддисоциационна смола. Циклизацията на смоли може да бъде по -малко ефективна от циклизацията на разтворителя, тъй като пептидите на смоли не образуват лесно циклирани конформации. Друг вид циклизация на страничната верига - образуването на амидна структура между аспарагинова киселина или остатък от глутаминова киселина и основната аминокиселина, което изисква групата за защита на страничната верига да може да бъде отстранена селективно от полипептида или върху смолата, или след дисоциация. Третият тип циклизация на страничната верига-страничната верига е образуването на дифенилови етери чрез тирозин или р-хидроксифенилглицин. Този тип циклизация в естествените продукти се намира само в микробните продукти, а продуктите за циклизация често имат потенциална лечебна стойност. Подготвянето на тези съединения изисква уникални реакционни условия, така че те не се използват често в синтеза на конвенционални пептиди.

(2) Терминал на Сидехейн
Терминалната верижна циклизация обикновено включва С-терминала с амино групата на страничната верига на лизин или орнитин, или N-терминалът със страничната верига на аспарагинова киселина или глутаминова киселина. Други полипептидни циклизация се прави чрез образуване на етерни връзки между терминал С и серин или треонин странични вериги.
(3) Тип терминал или от главата до опашката
Верижните полипептиди могат да бъдат циклични в разтворител, или да се фиксират върху смола от страничната верига. Ниските концентрации на пептидите трябва да се използват при централизацията на разтворителя, за да се избегне олигомеризация на пептидите. Добивът на синтетичен пръстен полипептид от главата до опашката зависи от последователността на верижния полипептид. Следователно, преди да се приготвят циклични пептиди в голям мащаб, първо трябва да се създаде библиотека с възможни верижни оловни пептиди, последвана от циклизация, за да се намери последователността с най -добри резултати.
2. N-метилиране
Първоначално N-метилирането се среща в естествени пептиди и се въвежда в пептиден синтез, за да се предотврати образуването на водородни връзки, като по този начин прави пептидите по-устойчиви на биоразграждане и клирънс. Синтезът на пептиди, използващи N-метилирани аминокиселинни производни е най-важният метод. В допълнение, може да се използва и реакция на Mitsunobu на N- (2-нитробензен сулфонил хлорид) полипептид-схема с метанол. Този метод е използван за приготвяне на циклични пептидни библиотеки, съдържащи N-метилирани аминокиселини.
3. Фосфорилиране
Фосфорилирането е една от най-често срещаните пост-транслационни модификации в природата. В човешките клетки повече от 30% от протеините са фосфорилирани. Фосфорилирането, особено обратимото фосфорилиране, играе важна роля за контролиране на много клетъчни процеси, като сигнална трансдукция, генна експресия, клетъчен цикъл и регулация на цитоскелета и апоптоза.
Фосфорилирането може да се наблюдава при различни аминокиселинни остатъци, но най -често срещаните цели на фосфорилиране са серин, треонин и тирозинови остатъци. Фосфотирозин, фосфотреонин и фосфосериново производно могат да бъдат въведени в пептиди по време на синтеза, или да се образуват след синтез на пептид. Селективното фосфорилиране може да бъде постигнато с помощта на остатъци от серин, треонин и тирозин, които селективно премахват защитните групи. Някои фосфорилиращи реагенти също могат да въведат групи от фосфорна киселина в полипептида чрез след модификация. През последните години е постигнато специфично за сайта фосфорилиране на лизин, като се използва химически селективна реакция на Staudinger-фосфит (Фигура 3).

4. Миристоилиране и палмитоилиране
Ацилирането на N-терминала с мастни киселини позволява пептиди или протеини да се свързват с клетъчните мембрани. Миридамоилираната последователност на N-терминала дава възможност на протеина на SRC семейството и обратите на GAQ протеините на транскриптаза GAQ да се свързват с клетъчните мембрани. Миристичната киселина е свързана с N-терминала на смола-полипептида, използвайки стандартни реакции на свързване и полученият липопептид може да бъде дисоцииран при стандартни условия и пречистен чрез RP-HPLC.
5. Гликозилиране
Гликопептидите като ванкомицин и теиколанин са важни антибиотици за лечение на устойчиви на лекарства бактериални инфекции, а други гликопептиди често се използват за стимулиране на имунната система. В допълнение, тъй като много микробни антигени са гликозилирани, е от голямо значение да се изследват гликопептидите за подобряване на терапевтичния ефект от инфекцията. От друга страна, е установено, че протеините върху клетъчната мембрана на туморните клетки проявяват анормално гликозилиране, което прави гликопептидите да играят важна роля в изследванията на рака и туморната имунна защита. Гликопептидите се приготвят по метод FMOC/T-BU. Гликозилираните остатъци, като треонин и серин, често се въвеждат в полипептиди чрез пентафлуорофенол естер FMOCs за защита на гликозилирани аминокиселини.
6. Изопрен
Изопентадиенилирането възниква върху цистеиновите остатъци в страничната верига близо до С-терминала. Протеиновият изопрен може да подобри афинитета на клетъчната мембрана и да образува взаимодействие на протеин-протеин. Изопентадинизираните протеини включват тирозин фосфатаза, малка GTASE, кохаперон молекули, ядрена ламина и центромерни свързващи протеини. Изопреновите полипептиди могат да се приготвят с помощта на изопрен върху смоли или чрез въвеждане на цистеинови производни.
7. Модификация на полиетилен гликол (PEG)
Модификацията на PEG може да се използва за подобряване на протеиновата хидролитична стабилност, биоразпределение и пептидна разтворимост. Въвеждането на PEG вериги в пептидите може да подобри техните фармакологични свойства и също така да инхибира хидролизата на пептидите чрез протеолитични ензими. PEG пептидите преминават през гломерулното капилярно напречно сечение по -лесно от обикновените пептиди, като значително намаляват бъбречния клирънс. Поради разширения активен полуживот на PEG пептидите in vivo, нормалното ниво на лечение може да се поддържа с по-ниски дози и по-рядко пептидни лекарства. Модификацията на PEG обаче също има отрицателни ефекти. Големите количества PEG не позволяват на ензима да разгради пептида и също така да намали свързването на пептида към целевия рецептор. Но ниският афинитет на PEG пептидите обикновено се компенсира от по-дългия им фармакокинетичен полуживот и като присъства в тялото по-дълго, PEG пептидите имат по-голяма вероятност да бъдат абсорбирани в целевите тъкани. Следователно спецификациите на PEG полимер трябва да бъдат оптимизирани за оптимални резултати. От друга страна, PEG пептидите се натрупват в черния дроб поради намален бъбречен клирънс, което води до макромолекулен синдром. Следователно, модификациите на PEG трябва да бъдат проектирани по -внимателно, когато пептидите се използват за тестване на лекарства.

Common modification groups of PEG modifiers can be roughly summarized as follows: Amino (-amine) -NH2, aminomethyl-Ch2-NH2, hydroxy-OH, carboxy-Cooh, sulfhydryl (-Thiol) -SH, Maleimide -MAL, succinimide carbonate -SC, succinimide acetate -SCM, succinimide propionate -SPA, n-hydroxysuccinimide -NHS, Acrylate-ch2ch2cooh, aldehyde -CHO (such as propional-ald, butyrALD), acrylic base (-acrylate-acrl), azido-azide, biotinyl -Biotin, Fluorescein, glutaryl -GA, Acrylate Hydrazide, alkyne-alkyne, P -толуенсулфонат -ots, сукцинимид сукцинат -ss и др. PEG производни с карбоксилни киселини могат да бъдат свързани с N -крайни амини или странични вериги на лизин. Аминоактивираният PEG може да бъде свързан със странични вериги на аспарагинова киселина или глутаминова киселина. MAL-активиран PEG може да бъде конюгиран с Mercaptan на напълно депрогнозирани странични вериги на цистеините [11]. Модификаторите на PEG обикновено се класифицират, както следва (Забележка: MPEG е метокси-PEG, CH3O- (CH2CH2O) N-CH2CH2-OH):
(1) Модификатор на PEG с права верига
MPEG-SC, MPEG-SCM, MPEG-SPA, MPEG-OTS, MPEG-SH, MPEG-ALD, MPEG-Butyrald, MPEG-SS
(2) Бифункционален модификатор на PEG
HCOO-PEG-COOH, NH2-PEG-NH2, OH-PEG-COOH, OH-PEG-NH2, HCL · NH2-PEG-COOH, MAL-PEG-NHS
(3) Модификатор на разклоняване на PEG
(MPEG) 2-NHS, (MPEG) 2-Ald, (MPEG) 2-NH2, (MPEG) 2-mal
8. Биотинизация
Биотинът може да бъде силно свързан с авидин или стрептавидин, а силата на свързване е дори близка до ковалентната връзка. Пептидите, маркирани с биотин, обикновено се използват при имуноанализ, хистоцитохимия и флуоресцентна проточна цитометрия. Маркираните антибиотинови антитела също могат да се използват за свързване на биотинилирани пептиди. Биотиновите етикети често са прикрепени към страничната верига на лизин или N терминала. 6-аминокапронова киселина често се използва като връзка между пептиди и биотин. Връзката е гъвкава при свързване към субстрата и се свързва по -добре при наличието на стерично препятствие.
9. Флуоресцентно етикетиране
Флуоресцентното етикетиране може да се използва за проследяване на полипептиди в живите клетки и за изследване на ензимите и механизмите на действие. Триптофан (TRP) е флуоресцентна, така че може да се използва за вътрешно етикетиране. Емисионният спектър на триптофана зависи от периферната среда и намалява с намаляване на полярността на разтворителя, свойство, което е полезно за откриване на пептидна структура и свързване на рецепторите. Триптофан флуоресценцията може да бъде гасената чрез протонирана аспарагинова киселина и глутаминова киселина, което може да ограничи употребата му. Групата на Дансилхлорид (Dansyl) е силно флуоресцентна, когато е свързана с амино група и често се използва като флуоресцентно етикет за аминокиселини или протеини.
Флуоресцентната резонансна енергия (FRET) е полезна за ензимни изследвания. Когато се прилага FRET, субстратният полипептид обикновено съдържа група с флуоресцентно маркиране и група за укрепване на флуоресценцията. Маркираните флуоресцентни групи се гасят от гасенето чрез пренос на енергия, който не е фототон. Когато пептидът се отделя от въпросния ензим, етикетиращата група излъчва флуоресценция.
10. Полипептиди на клетката
CAGE пептидите имат оптично сменяеми защитни групи, които предпазват пептида от свързване към рецептора. Когато се излага на UV лъчение, пептидът се активира, като възстановява афинитета му към рецептора. Тъй като това оптично активиране може да бъде контролирано според времето, амплитудата или местоположението, клетъчните пептиди могат да се използват за изследване на реакциите, възникващи в клетките. Най-често използваните защитни групи за полипептиди на клетката са 2-нитробензилови групи и техните производни, които могат да бъдат въведени в синтеза на пептиди чрез защитни аминокиселинни производни. Аминокиселинните производни, които са разработени, са лизин, цистеин, серин и тирозин. Аспартатните и глутаматни производни обаче не се използват често поради чувствителността им към циклизация по време на синтеза и дисоциацията на пептидите.
11. Полиантигенен пептид (MAP)
Кратките пептиди обикновено не са имунизирани и трябва да бъдат съчетани с протеини на носители, за да произвеждат антитела. Полиантигенният пептид (MAP) е съставен от множество идентични пептиди, свързани с лизин ядра, които могат специфично да експресират имуногени с висока потентност и могат да се използват за приготвяне на протеинови куплети на пептид-носител. MAP полипептидите могат да бъдат синтезирани чрез синтез на твърда фаза върху смола на MAP. Въпреки това, непълното свързване води до липсващи или отсечени пептидни вериги на някои клони и по този начин не показва свойствата на оригиналния полипептид на MAP. Като алтернатива пептидите могат да се приготвят и пречистват отделно и след това да се свържат с картата. Пептидната последователност, прикрепена към ядрото на пептида, е добре дефинирана и лесно се характеризира с масспектрометрия.
Заключение
Модификацията на пептидите е важно средство за проектиране на пептиди. Химически модифицираните пептиди могат не само да поддържат висока биологична активност, но и ефективно да избягват недостатъците на имуногенността и токсичността. В същото време химическата модификация може да надари пептиди с някои нови отлични свойства. През последните години методът за активиране на С-Н за постмодификация на полипептиди е бързо развит и са постигнати много важни резултати.
Време за публикация: 2025-07-03
